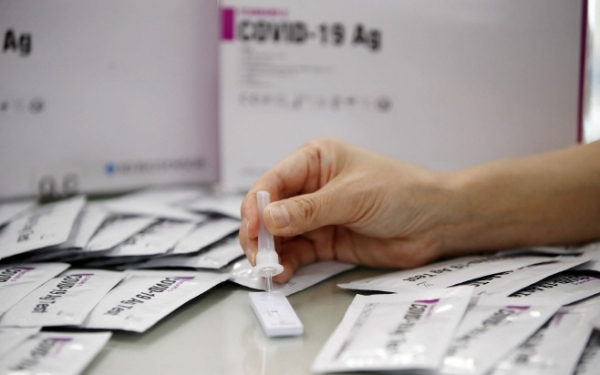
[이슈밸리=박지영 기자] 식품의약품안전처가 신종 코로나바이러스(코로나19) 자가검사키드 첫 번째 품목허가했다.
23일 식약처는 코로나19 자가 검사가가능한 항원방식 자가검사키트 2개 제품에 대해 추후 자가검사에 대한 추가 임상적 성능시험 자료 등을 3개월 내에 제출하는 조건으로 품목허가했다고 밝혔다.
이번에 허가한 코로나19 자가검사키트 두 제품은 국내에서 전문가용으로 허가를 받은 제품이고 해외에서는 자가검사용 임상시험을 실시해 긴급사용승인 등을 받은 바 있다.
먼저 에스디바이오센서 제품은 지난 해 11월 우리 처에 임상적 민감도 90%(54/60명), 특이도 96%(96/100명)로 전문가용 제조품목 허가를 받은 바 있으며 독일, 네덜란드, 덴마크, 스위스, 포르투칼, 룩셈부르크, 체코 등 7개국에서 자가검사용으로 사용 중이다.
휴마시스의 경우 지난 3월 우리 처에 임상적 민감도 89.4%(59/66명), 특이도 100%(160/160명)로 전문가용 허가를 받은 바 있으며 체코, 덴마크, 오스트리아 등 3개국에서 자가검사용으로 사용되고 있다.
이번 두 제품은 코로나19 확산 및 대유행 우려에 따라 전문가가 아닌 개인이 손쉽게 자가검사를 할 수 있는 보조적인 수단이나 이번 조건부 허가 제품은 정식허가 제품이 나오기 이전에 한시적으로 사용하는 제품이다.
또 두 제품은 코로나19 감염 증상의 확진이 아닌 보조적인 수단으로만 사용해야 하며 유전자 검사 결과와 임상증상 등을 고려하여 의사가 감염 여부를 최종 판단해야 한다.
식약처는 "조건부 허가제품을 대체할 품질이 우수한 정식허가 제품의 신속 개발·허가를 적극적으로 지원해 우리 국민이 충분한 진단‧치료 기회를 보장받을 수 있도록 최선을 다할 것"이라고 밝혔다.